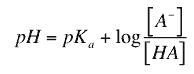Desde entonces, el término pH ha sido universalmente utilizado por la facilidad de su uso, evitando así el manejo de cifras largas y complejas. En disoluciones diluidas en lugar de utilizar la actividad del ion hidrógeno, se le puede aproximar utilizando la concentración molar del ion hidrógeno.
Por ejemplo, una concentración de [H+] = 1 × 10–7 M (0,0000001) es simplemente un pH de 7 ya que : pH = –log[10–7] = 7
El pH típicamente va de 0 a 14 en disolución acuosa, siendo ácidas las disoluciones con pH menores a 7, y básicas las que tienen pH mayores a 7. El pH = 7 indica la neutralidad de la disolución (siendo el disolvente agua). Se considera que p es un operador logarítmico sobre la concentración de una solución: p = –log[...] , también se define el pOH, que mide la concentración de iones OH-.
Medida del pH
El valor del pH se puede medir de forma precisa mediante un potenciómetro, también conocido como pHmetro, un instrumento que mide la diferencia de potencial entre dos electrodos: un electrodo de referencia (generalmente de plata/cloruro de plata) y un electrodo de vidrio que es sensible al ión hidrógeno.
También se puede medir de forma aproximada el pH de una disolución empleando indicadores, ácidos o bases débiles que presentan diferente color según el pH, como la Fenolftaleína. Generalmente se emplea papel indicador, que se trata de papel impregnado de una mezcla de indicadores.
A pesar de que muchos potenciómetros tienen escalas con valores que van desde 1 hasta 14, los valores de pH pueden ser menores que 1 y mayores que 14.
Un pH igual a 7 es neutro, menor que 7 es ácido y mayor que 7 es básico a 25ºC. A distintas temperaturas, el valor de pH neutro puede variar debido a la constante de equilibrio del agua (Kw).